
为构建科学的医疗器械监管体系,加快与国际接轨,2020年3月,我国等同转化IMDRF第三版《医疗器械安全和性能基本原则》(以下简称《基本原则》)。《基本原则》是基于通用风险提炼出的医疗器械安全有效基本要求,注册申请人应自觉履行主体责任,将《基本原则》要求融入医疗器械的研发和生产过程中,在质量管理体系的控制下,形成相应的符合性证据,注册时作为证明产品安全有效的申报资料提交。
为进一步指导注册申请人科学合理地运用《基本原则》进行产品研发和注册申报,确保医疗器械安全有效,国家药监局器审中心基于当前认知水平和审评工作实际情况,组织编写了《<医疗器械安全和性能基本原则>符合性技术指南》,现予发布。
特此通告。
附件:1.医疗器械安全和性能基本原则符合性技术指南
2.医疗器械安全和性能基本原则符合性技术指南使用说明
国家药品监督管理局
医疗器械技术审评中心
2022年7月12日
【附件1】
医疗器械安全和性能基本原则符合性技术指南
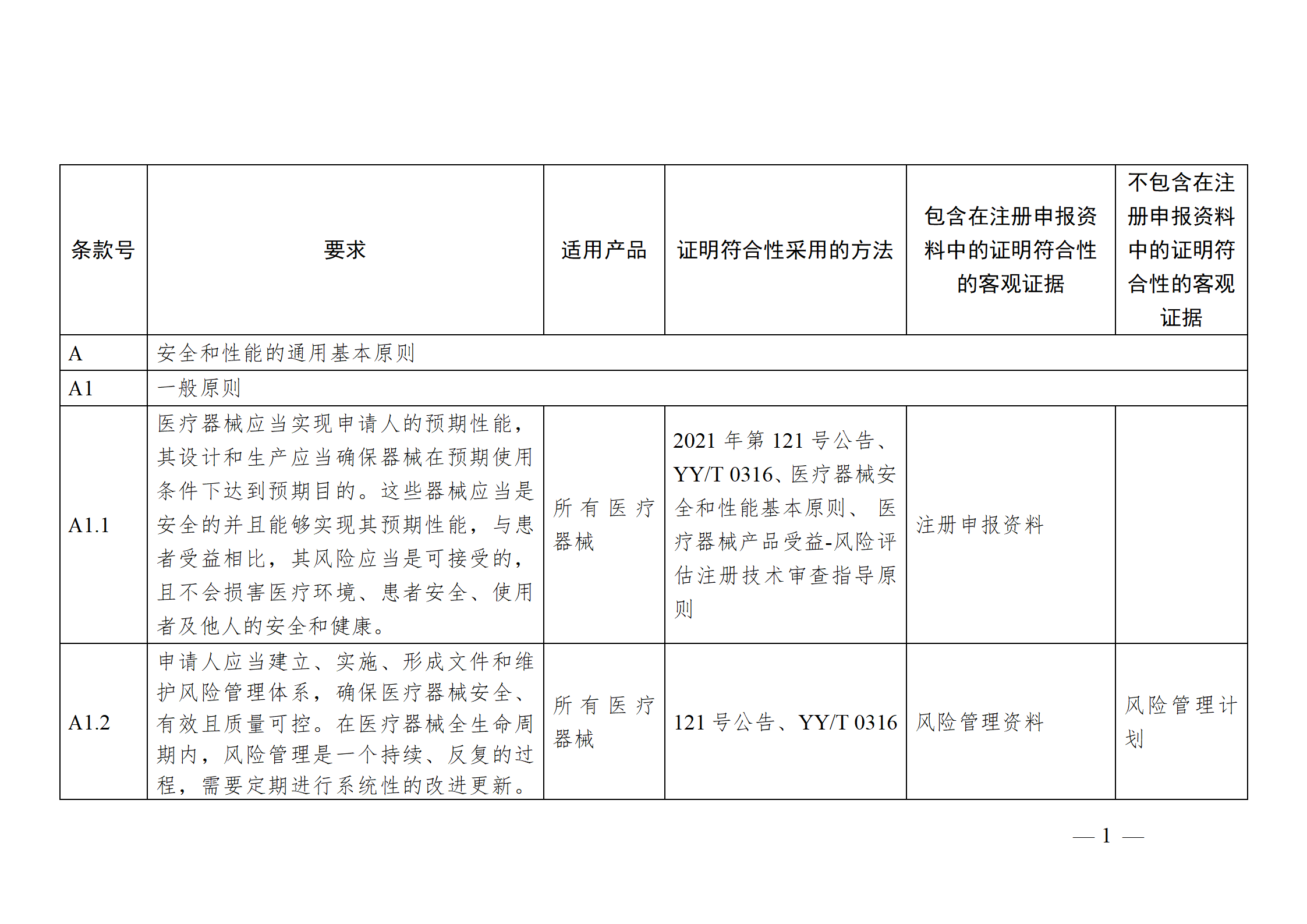




























【附件2】
医疗器械安全和性能基本原则符合性技术指南使用说明
医疗器械直接关系人民群众生命健康,《医疗器械注册与备案管理办法》(国家市场监督管理总局令 第47号)第十三条规定:“医疗器械注册、备案应当遵守相关法律、法规、规章、强制性标准,遵循医疗器械安全和性能基本原则,参照相关技术指导原则,证明注册、备案的医疗器械安全、有效、质量可控,保证全过程信息真实、准确、完整和可追溯。”2020年3月,国家药品监督管理局发布的《医疗器械安全和性能基本原则》(以下简称《基本原则》)是基于通用风险提炼出的医疗器械安全有效基本要求,是技术审评决策的重要依据。
为进一步指导注册申请人科学合理地运用《基本原则》,将《基本原则》的要求高质量地融入产品研发和生产过程中,以确保医疗器械产品的安全有效,并在此基础上,准确填写注册申报资料中的《医疗器械安全和性能基本原则清单》,器审中心通过组织查阅相关法规、标准和指导原则等文件,结合技术审评要求,编写了《医疗器械安全和性能基本原则符合性技术指南》(以下简称《指南》)。《指南》是对所有医疗器械的通用要求,现将有关使用方法说明如下:
一、判断适用性,确定证明符合性采用的方法
注册申请人应结合产品特性,根据《指南》中“适用产品”一栏,确定《基本原则》各项具体要求的适用性。对于适用的要求,在产品研发时,可优先参考指南中“证明符合性采用的方法”一栏中给出的可参考的标准或指导原则,也可采用121号公告附件9中说明的方法,包括企业自定的方法、普遍接受的测试方法、与已批准上市的同类产品的比较等。
二、按照确定的方法形成相应的符合性证据
注册申请人按照确定的证明符合性的方法,在产品研发和生产过程中形成相应的客观证据。对于每个条款可能涉及的证据,《指南》以“包含在注册申报资料中的证明符合性的客观证据”和“不包含在注册申报资料中的证明符合性的客观证据”两栏进行了提示,列出了证据对应的具体申报资料文件名称。
三、将形成的符合性证据整理形成注册申报资料
注册申请人将证明符合性的客观证据整理形成注册申报资料(含《医疗器械安全和性能基本原则清单》(以下简称《清单》)。证据包含在产品注册申报资料中,应当在《清单》中说明其在申报资料中的具体位置。证据未包含在产品注册申报资料中,应当在《清单》中注明该证据文件名称及其在质量管理体系文件中的编号备查。
《指南》中证明符合性的客观证据列出了所有医疗器械可能涉及的证据,对于不同的产品,涉及的证据可能不同,并不一定需要《指南》中所列全部证据。《指南》中包含在产品注册申报资料中的证据涉及可用性研究的,注册申请人应在质量管理体系控制下,在产品研发过程中开展相应的研究,但目前注册申报资料不做统一要求。对于可用性研究有明确要求的产品(例如指导原则、审评要点等),需要在注册申报资料中提交。
《指南》为提供注册申请人和审查人员使用的指导性文件,不涉及注册审批等行政事项,亦不作为法规强制执行,如有能够满足法规要求的其他方法,也可采用,但应提供详细的研究资料。本指南是在现行法规体系及当前认知水平下制定的,随着法规的不断完善和科学技术的不断发展,相关内容也将适时进行调整。
【附件下载请扫描下方二维码】

