医疗器械主文档是一种技术资料形式,该类资料由其所有者提交给医疗器械技术审评机构,用于授权医疗器械注册申请人在申报医疗器械注册等事项时引用其作为注册申报资料的一部分。医疗器械主文档制度可以方便医疗器械生产企业选择原材料和关键元器件,简化注册申报。同时,主文档资料登记的自愿原则和保密原则,可以很好的保护主文档所有者的知识产权。
PEEK聚醚醚酮是一种具有耐高温、自润滑、易加工和高机械强度等优异性能的高分子聚合物,由于PEEK可耐反复的灭菌,在医疗器械中可用于制造内窥镜零件、牙科用的去垢器等。另外,由于PEEK的高强度和低溶出性,还可用于仪器分析的液相色谱柱、管、附件等。而且由于PEEK与人体具有很好的相融性,可作为人工骨材料修复骨缺损以及作为一些植入器械的原材料。
医疗器械原材料(体外诊断试剂除外)的技术资料一般是指原材料组成成分描述、理化性能研究资料、生物学评价资料、毒理学风险分析资料,工艺研究等。PEEK可参考以下指标进行试验。
(1)理化性能
包括拉伸强度(屈服)、拉伸强度(断裂)、断裂伸长率、弯曲强度、弯曲模量、悬臂梁缺口冲击强度、密度、黏度、玻璃化转变温度、熔融峰温、负荷变形温度,重金属含量等,具体可参考YY/T 0660 外科植入物用聚醚醚酮(PEEK)聚合物的标准规范和GB/T 41873-2022塑料 聚醚醚酮(PEEK)树脂。
(2)鉴别
PEEK主要通过红外光谱进行鉴别,主要吸收峰与标准对照图谱的特征吸收峰要一致。典型谱图如下:
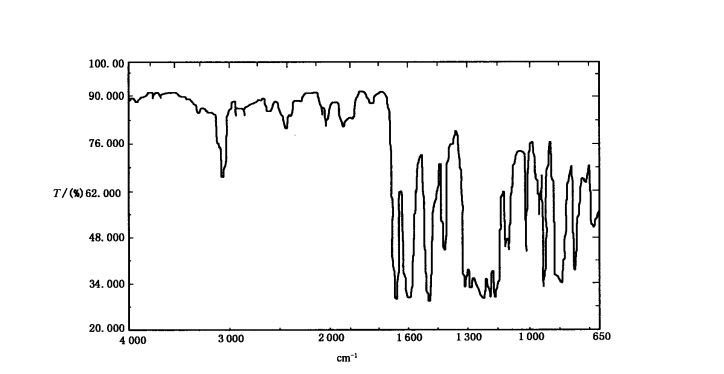
(3)生物相容性
作为医疗器械的原材料,可根据终端产品按照GB/T 16886.1的要求进行相应的生物学试验。例如作为外科植入物,在使用过程中与人体皮肤接触,肌肉,骨组织等接触,接触时间为持久(大于30d)。则考虑细胞毒性、致敏反应、刺激或皮内反应、材料介导的致热性、急性全身毒性、亚急性毒性、亚慢性毒性,慢性毒性,植入反应,遗传毒性和致癌性试验项目。
(4)灭菌验证
PEEK可耐反复的灭菌,用PEEK制造的医疗器械及医疗器械部件可被灭菌。可使用的灭菌方法包括蒸汽、环氧乙烷以及射线灭菌。但重复灭菌可能会削弱材料本身的强度和理化性能,因此生产企业需要对进行不同灭菌方式以及灭菌次数的研究,以验证PEEK在规定的灭菌方式和灭菌次数后性能,结构组成,生物学等方面依旧符合要求。
(5)货架有效期和包装运输
登记产品可考虑按照医疗器械对原材料的要求进行有效期和包装运输验证,可参考《无源植入性医疗器械货架有效期注册申报资料指导原则》、GBT 19633系列、YYT 0681系列等依据进行相关试验。
截止到2024年11月19日,国家局已成功登记的PEEK原材料产品有9款,汇总如下:
序号 | 所有者名称 | 主文档登记事项名称 | 主文档登记号 | 登记/更新时间 |
27 | 武汉北慕科技有限公司 | 聚醚醚酮(PEEK)注塑工艺主文档 | M2021027-001 | 2023-01-04 |
73 | 麟科泰医疗技术(无锡)有限公司 | 等离子喷涂纯钛涂层"Spondycoat® - T 107"在PEEK基材上的医学应用主文档 | M2022041-002 | 2024-03-15 |
82 | 麟科泰医疗技术(无锡)有限公司 | 等离子喷涂纯钛涂层"Spondycoat® - T 371A"在PEEK基材上的医学应用 | M2022050-001 | 2023-04-21 |
140 | 广州聚生医疗科技有限公司 | 外科植入物用聚醚醚酮(PEEK)原材料主文档 | M2022108-000 | 2022-11-28 |
313 | 常州君华医疗科技有限公司 | AKSOPEEK医用植入级PEEK纯料主文档 | M2023173-002 | 2024-04-11 |
324 | 英国Invibio有限公司 | PEEK-OPTIMA® 碳纤维增强型聚醚醚酮复合材料 | M2023184-000 | 2023-12-26 |
432 | 常州君华医疗科技有限公司 | 短切碳纤维植入级PEEK材料主文档 | M2024102-001 | 2024-08-10 |
453 | 英国Invibio有限公司 | PEEK-OPTIMA® 长链碳纤维超级增强型聚醚醚酮复合材料 | M2024123-000 | 2024-05-11 |
486 | 吉林省中研高分子材料股份有限公司 | PEEK-LISCIEX 聚醚醚酮原材料主文档 | M2024156-000 | 2024-06-08 |
更多主文档登记信息可在【国家药品监督管理局医疗器械技术审评中心-信息公开-主文档登记信息公示】栏查看。
